Στοχευμένη θεραπεία για τη χρόνια μυελογενή λευχαιμία. Θεραπεία της χρόνιας μυελογενούς λευχαιμίας ανάλογα με το μοριακό προφίλ του όγκου
Ειδικός Παθολόγος-Ογκολόγος, MD, PhD

Χρόνια μυελογενής λευχαμία
Το καλύτερο παράδειγμα στοχευμένης θεραπείας…
Η παθογνωμική t(9;22) μετάθεση που δημιουργεί το χρωμόσωμα Philadelphia είναι υπεύθυνη για την παθογένεση της χρόνιας μυελογενούς λευχαιμίας.
Η σύντηξη των BCR 5’/Breakpoint Cluster Region/Περιοχή Ομάδας Σημείου Διάσπασης 5′ και των ABL 3’/Tyrosine-protein kinase ABL1/Abelson murine leukemia viral oncogene homolog 1/ομόλογο ογκογονιδίου 1 του ιού λευχαιμίας ποντικού Abelson, πρωτεΐνη τυροσινικής κινάσης εξονίων έχει σαν αποτέλεσμα το σχηματισμό ενός γονιδίου που κωδικοποιεί την άναρχη ABL κινάση. Η ABL κινάση έχει μεταφορική δραστηριότητα και διατηρεί τoν ενζυματικό τομέα της πρωτεϊνης ABL που τώρα έχει χάσει το φυσιολογικό ρυθμιστικό N- τερματικό άκρο και της έχει προστεθεί η δραστηριότητα τυροσινικής κινάσης.
Η μεταφορά του BCR-ABL/BCR (Breakpoint Cluster Region) and ABL1 (Abelson murine leukemia viral oncogene homolog 1)/BCR (Περιοχή Ομάδας Σημείου Διάσπασης) και ABL1 (ομόλογο ογκογονιδίου 1 του ιού λευχαιμίας ποντικού Abelson) γονιδίου σε ένα φυσιολογικό κύτταρο προκαλεί μετατροπή του. Η κινάση BCR-ABL δεσμεύει την ATP/adenosine triphosphate/τριφωσφορική αδενοσίνη, που απαιτείται για την δραστηριότητά της. Έτσι, φτιάχτηκε ένα μόριο το οποίο είναι γνωστό ότι μπλοκάρει την ενσωμάτωση της ATP στις πρωτεΐνες. Οι ερευνητές βελτίωσαν την ειδικότητά του και τροποποίησαν τη δομή του και έφτιαξαν ένα φάρμακο από το στόμα που στοχεύει τον καρκίνο εκεί που υπάρχει το πρόβλημα.
Το φάρμακο που προέκυψε είναι η imatinib mesylate που έχει μεγάλη ειδικότητα για την περιοχή όπου δεσμεύεται η ATP και παγιδεύει το BCR-ABL και το κάνει ανενεργό. Επειδή, η Χρόνια μυελογενής λευχαμία εξαρτάται εντελώς από την δραστηριότητα του BCR-ABL, η αναστολή του οδηγεί σε αναστολή της κυτταρικής ανάπτυξης και απόπτωση. Ο σημαντικός ρόλος της δραστηριότητας του BCR-ABL για τον κακοήθη φαινότυπο φαίνεται από τα υψηλά ποσοστά ύφεσης της νόσου που πραγματοποιείται με τη θεραπεία με την ιματινίμπη στην ΧΜΛ.
Παρότι οι υφέσεις αυτές είναι μικρής διάρκειας, η αποτελεσματικότητα του φαρμάκου στην οξεία λευχαιμική φάση, που χαρακτηρίζεται από την παρουσία και άλλων μεταλλάξεων, δείχνει το ρόλο που παίζει το παθογνωμικό γονίδιο. Σε μερικές περιπτώσεις, βέβαια, η κλινική ύφεση που παρατηρείται από την imatinib mesylate, συνοδεύεται από κυτταρογενετικές ή μοριακές υφέσεις οι οποίες φαίνονται από την απουσία των BCR-ABL αλληλουχιών στην PCR/polymerase chain reaction/αλυσιδωτή αντίδραση πολυμεράσης.
Η αντίσταση στη θεραπεία με ιματινίμπη γρήγορα συμβαίνει στην οξεία φάση της λευχαιμίας και αργά στην χρόνια φάση της νόσου. Σε κάθε περίπτωση, ο μηχανισμός αντίστασης οδηγεί σε αυξημένη δραστηριότητα του BCR-ABL παρά την ύπαρξη θεραπευτικών επιπέδων ιματινίμπης. Η αντίσταση πετυχαίνεται με ενίσχυση του γονιδίου σύντηξης BCR-ABL ή με σημειακή μετάλλαξη της αλληλουχίας του που ελαττώνει την συγγένεια δέσμευσης με το ATP ή μεταβάλλει το σχήμα του BCR-ABL και δε γίνεται η δέσμευση με την ιματινίμπη.
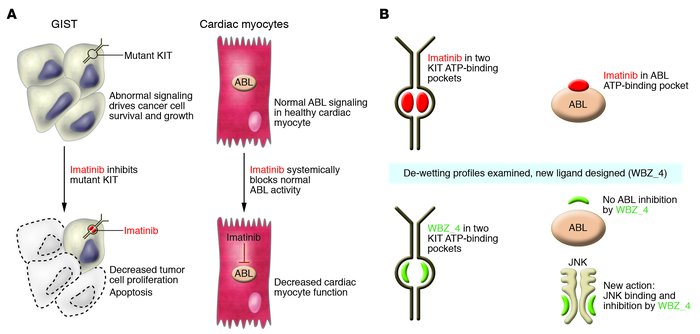
Η ιματινίμπη έχει αποτέλεσμα και σε άλλους καρκίνους
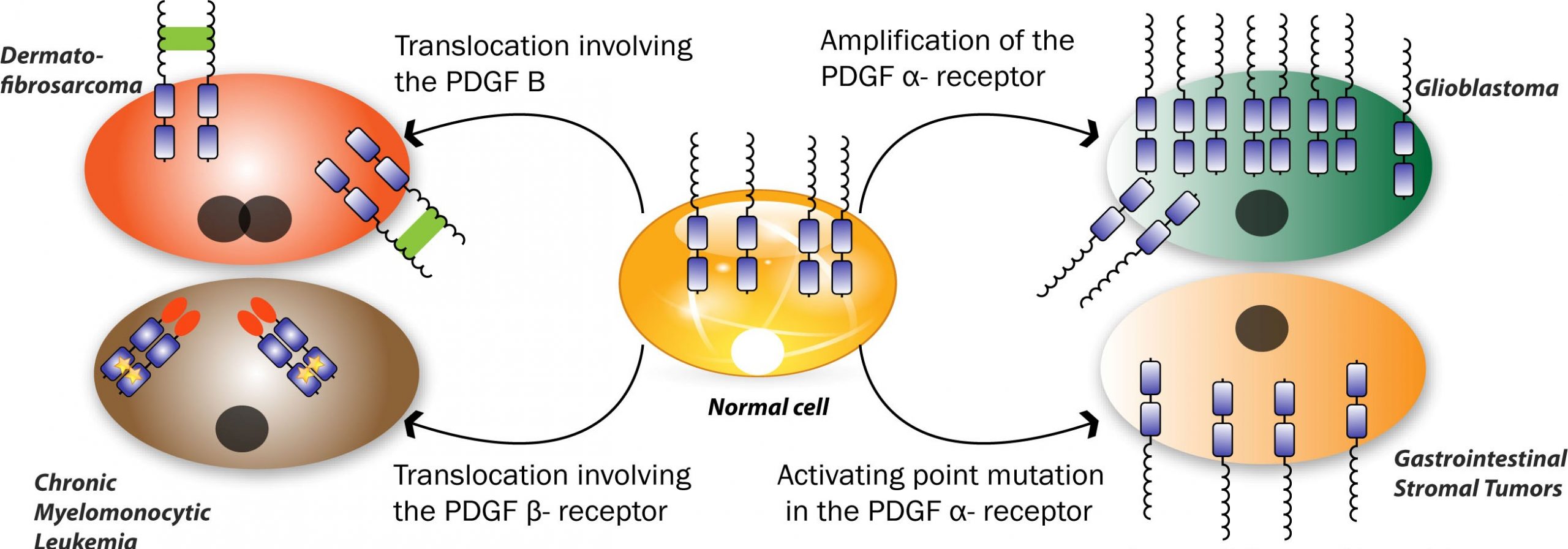
Η ιματινίμπη επηρεάζει τουλάχιστον άλλες τρεις κινάσες: C-KIT ή CD117/υποδοχέας τυροσινικής κινάσης, PDGFRA/platelet-derived growth factor receptor alpha/υποδοχέας άλφα αυξητικού παράγοντα που προέρχεται από αιμοπετάλια και PDGFRB/Platelet-Derived Growth Factor Receptor Beta/Υποδοχέας Βήτα του Παράγοντα Ανάπτυξης που Προέρχεται από τα Αιμοπετάλια. Όταν κάποιο από αυτά τα γονίδια είναι υπαίτιο για την ανάπτυξη του καρκίνου η ιματινίμπη είναι αποτελεσματική θεραπεία.
Ο C-KIT ενεργοποιείται με ενίσχυση στους στρωματικούς γαστρεντερικούς όγκους.
Μερικές χρόνιες μυελοϋπερπλαστικές νόσοι ενεργοοιούνται από το γονίδιο του PDGFRB που κωδικοποιεί έναν υποδοχέα της τυροσινικής κινάσης. Το γονίδιο βρίσκεται στο χρωμόσωμα 5q33 και η ενεργοποίηση του, συνήθως, προκαλείται από μια μετάθεση t(5;12)(q33;p13) που δημιουργεί ένα γονίδιο σύντηξης το ETV6 translocation-Ets-leukemia virus 6/ιός λευχαιμίας Ets-μετατόπισης-PDGFRB. Η ιματινίμπη αναστέλλει το PDGFRB και προκαλεί υφέσεις σε αυτές τις χρόνιες μυελοϋπερπλαστικές νόσους.
Η ενεργοποίηση του PDGFRA προκαλεί το υπερηωσινοφιλικό σύνδρομο που είναι ευαίσθητο στην ιματινίμπη.
Πατήστε, εδώ, για να διαβάσετε για την ιματινίμπη και τις παρενέργειές της
Η θεραπεία του καρκίνου πρέπει να αλλάξει και να γίνεται στοχευμένα ανάλογα με το μοριακό προφίλ του όγκου.
Να προτιμάτε τις φυσικές θεραπείες για τη Χρόνια Μυελογενή Λευχαιμία, σύμφωνα με το Μοριακό Προφίλ του Όγκου
Η ζωή είναι πολύτιμη.
Η ζωή είναι δική σας. Πάρτε την στα χέρια σας!
Το μοριακό προφίλ του όγκου είναι απαραίτητο και χρήσιμο εργαλείο για τη θεραπευτική σας απόφαση.
Ζητείστε την εξέταση πριν κάνετε οποιαδήποτε θεραπεία. Η ζωή σας είναι πολύτιμη.
Ζητήστε από την EMEDI πληροφορίες για το μοριακό προφίλ του όγκου.


Γράφει η
Δρ Σάββη Μάλλιου Κριαρά
Ειδικός Παθολόγος- Ογκολόγος, MD, PhD
Διαβάστε περισσότερα για την Σάββη Μάλλιου Κριαρά
Τα κατάλληλα συμπληρώματα διατροφής για τη χρόνια μυελογενή λευχαιμία
Η καθοδήγηση για την επιλογή των ποιων συμπληρωμάτων διατροφής, από τα ανωτέρω, είναι κατάλληλα για την ασθένειά σας θα γίνει σε συνεννόηση με το θεράποντα ιατρό.
Διαβάστε, επίσης,
Θεραπεία του καρκίνου εξατομικευμένα
Η μεγάλη υπόθεση για τη θεραπεία του καρκίνου
Τα ογκοκατασταλτικά γονίδια στον Κυτταρικό Κύκλο
Η χρήση του καρυότυπου στην ογκολογία
Διαγνωστικά τεστ του ανθρώπινου γονιδιώματος
Ο ρόλος της απόπτωσης στον καρκίνο
Ο ρόλος του p53 στον καρκίνο του μαστού
Οι ενδοκρινολογικές αιτίες πυρετού
Γιατί κάποιος παθαίνει λευχαιμία
Νέα ένδειξη για την ιματινίμπη
Nilotinib για την χρόνια μυελογενή λευχαιμία
Οι στρωματικοί όγκοι γαστρεντερικού συστήματος μοντέλο στοχευόμενης θεραπεία
Στρωματικοί όγκοι γαστρεντερικού συστήματος





